今日やった分
化学
今日やったこと高校化学(理論化学)
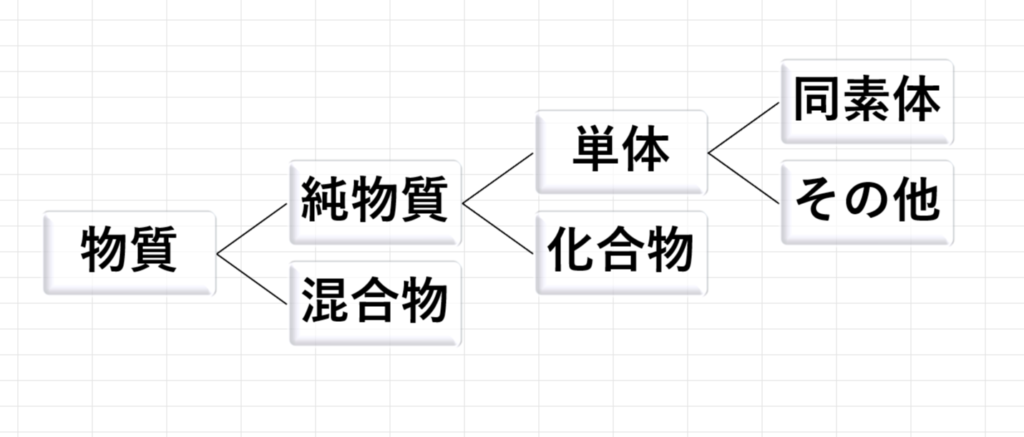
物質の分類法
すべての物質は原子で出来ています。つまりすべての物質は原子によって分けることができます。
純物質と混合物
・純物質…1つの化学式で表されるもの
【例】水(H₂O)や塩化ナトリウム(NaCl)、酸素(O₂)やアルミニウム(Al)、エタノール(C2H5OH)も純物質です。
・混合物…二種類以上の純物質が混ざったもの
【例】海水(ほぼH₂OとNaCl)、空気(ほぼO₂とN₂とCO₂とAr)。
純物質と混合物で大切なことが2つあります。
①水溶液は混合物であること
例えば食塩(NaCl)は純物質ですが、食塩水になると食塩と水の混合物になります。二酸化炭素(CO₂)は純物質ですが、炭酸水になると混合物です。
塩酸も気体の塩化水素(HCl)を水に溶かした水溶液なので混合物です。
②純物質は融点や沸点が一定であること
純物質には決まった性質がありますが、混合物は純物質の割合によって、融点や沸点が変わってきます。
単体と化合物
・単体…1種類の元素からできている物質
【例】水素(H₂)、銅(Cu)、酸素(O₂)やオゾン(O₃)。
・化合物…2種類以上の元素からできている物質
【例】塩化ナトリウム(NaCl)、水(H₂O)。
同素体とは
さっきの単体の例の酸素(O₂)とオゾン(O₃)のように、単体のなかでも同じ元素からできているのに性質や結合の仕方が違っている単体を互いに同素体といいます。
有名な同素体(暗記)
・硫黄S (単斜硫黄、斜方硫黄、ゴム状硫黄)
・炭素C (黒鉛、ダイアモンド、フラーレン)
・酸素O (酸素、オゾン)
・リンP (赤リン、黄リン)
元素記号でまとめてSCOP(スコップ)と覚えましょう。
同素体と同位体の違い
さきほど紹介した同素体と非常によく間違われるのが同位体です。
どちらも同じ元素からなる単体の種類で、性質や結合の仕方が異なるものを同素体、質量数が異なる(中性子の数が違う)を同位体といいます。
疲れたーーーーーーーーー


コメント